|
к разделу "ХИМИЯ"
ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ
Татьяна Кузьмина,
Ульяновск astera52@mail.ru
1. Каково строение атома железа? Каковы степени окисления его в соединениях (с примерами)?
2. Назовите формулы природных соединений железа.
3. Каковы физические свойства железа?
4. Какова активность железа в химических реакциях?
5. Как может окисляться железо?
6. Какова степень окисления железа в железной окалине?
7. Как горячая вода разрушает железо?
8. Как различается взаимодействие железа с хлором и соляной кислотой?
9. В чем разница окисления железа сильными и слабыми окислителями?
10. Как реагирует железо с серной и азотной кислотами?
11. Какие металлы могут быть вытеснены железом из растворов и солей?
12. Каково биологическое значение железа?
13. От чего зависит коррозионная стойкость железа?
14. Какие оксиды железа тебе известны? Каковы степени окисления железа в них?
15. Как можно получить оксид железа (II)? Как доказать его основной характер?
16. Как можно получить оксид железа (III)? Как доказать его амфотерность?
17. Какие гидрокcиды образует железо? Каков их химический характер?
18. Почему гидрокcид железа (II) буреет на воздухе?
19. Как можно получить гидрокcиды железа в лаборатории?
20. Как ведут себя эти гидрокcиды при нагревании?
21. Какой из гидроксидов железа амфотерен? Как он взаимодействует с щелочами?
22. Как окрашены растворы солей железа и от чего зависит их окраска?
23. Как распознать соли двухвалентного железа?
24. Как распознать соли трехвалентного железа?
25. Где человек применяет железо?
Задачи и упражнения.
1.Как, исходя из железа, получить: а) гидроксид железа (II) б) гидроксид железа (III)?
2.Приведите по 2 уравнения реакций окисления железа простыми и сложными веществами.
3.Будут ли изменяться на воздухе при прокаливании: а) оксид ртути (II) б) оксид железа (II) в) оксид железа (III) г) медь д) платина д) оксид алюминия? Почему? Напишите уравнения возможных реакций.
1. Как очистить раствор сульфата железа (III) от сульфата меди (II)?
2. В каком случае выделится больше водорода: при реакции с раствором серной кислоты 30 г цинка или 20 г железа?
6.При действии на сплав железа с медью избытка соляной кислоты выделилось 224 мл газа. Вычислите массу сплава, если железа в нем содержалось 20% по массе.
7. Составьте у/р по схеме:
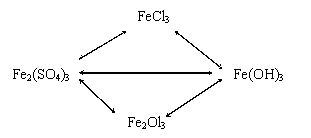
8.Какой из известных вам оксидов железа наиболее богат железом? Как это доказать расчетом?
9.Минерал содержит 72,36% железа и 27,64% кислорода. Определите формулу минерала.
10.Сколько г сульфата железа (II) можно получить при растворении 140 г железа в разбавленной серной кислоте?
11.Сколько г гидроксида железа (III) можно получить при взаимодействии 120 г гидроксида натрия с избытком хлорида железа (III)?
12.Составьте у/р по схемам:
а) Fe 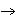 Fe 2 O 3 Fe 2 O 3 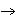 FeCl3 Fe(OH) 3 FeCl3 Fe(OH) 3 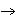 K[ Fe(OH) 4 ] K[ Fe(OH) 4 ]
б) Fe FeSO 4 FeSO 4  Fe(OH) 2 Fe(OH) 2  Fe(OH) 3 Fe(OH) 3  Fe 2 (SO 4 ) 3 Fe 2 (SO 4 ) 3
13.Напишите уравнения практически осуществимых реакций:
а) |
Fe + HCl |
е) |
Fe(OH) 3 + KCl  |
б) |
Fe 2 O 3 + HNO 3  |
ж) |
FeSO 4 + Ba(NO) 3  |
в) |
Fe 2 O 3 + H 2 O 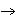 |
з) |
Fe(OH) 2 v + H 2 SO 4 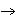 |
г) |
FeCl 2 + Cl 2 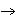 |
и) |
FeSO 4 + NaCl 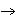 |
д) |
FeSO 4 + Cu  |
к) |
Fe 2 O 3 + Al  |
_____________________________________________
Репетиторство по электронной почте: astera52@mail.ru
|



